最近,美国卫生与公众服务部(HHS)下属国家医学图书馆上发布了的一篇综述论文如下:
大麻二酚(CBD)是一种从大麻植物中提取的非精神活性成分,已在多种疾病中显示出治疗效果,包括焦虑症,神经系统疾病,炎症和肿瘤。CBD可通过调节细胞周期、诱导肿瘤细胞凋亡和自噬、抑制肿瘤细胞侵袭、迁移和血管生成等途径发挥其抗肿瘤作用。本文就CBD的抗肿瘤作用机制进行综述,旨在为临床治疗肿瘤疾病及合理使用CBD提供参考。
文献链接:
https://pubmed.ncbi.nlm.nih.gov/38731434/

1、大麻素CBD介绍
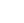
大麻二酚(CBD)和Δ9—四氢大麻酚(THC)是从大麻植物中提取的纯天然成分,是研究最广泛的两种植物大麻素。纯CBD的特性之一是它具有浅黄色晶体,易溶于乙醇、甲醇和乙醚等有机溶剂,几乎不溶于水。酚羟基有助于提高CBD的最高占据分子轨道值,因此酚羟基是大麻二酚抗氧化性能的结构基础。
随着研究的深入,CBD还被发现具有抗炎、抗肿瘤、止吐等作用.。THC是大麻的主要精神活性成分,它可以作为部分激动剂,与相应的受体结合,发挥多种生理作用。研究表明,THC具有显著的镇痛和止吐作用,但其临床应用受到焦虑和认知障碍等精神副作用的限制。与THC不同,CBD不会损害精神系统,事实上,它可以预防和逆转由THC诱导的细胞外调节激酶(ERK)通路过度激活引起的焦虑和成瘾。
CBD的抗肿瘤活性已引起越来越多的关注,并已在各种肿瘤类型中得到证实,如结直肠癌、肺癌、乳腺癌、卵巢癌和前列腺癌。CBD抗肿瘤机制包括诱导细胞周期停滞和自噬、促进细胞凋亡、调节血管生成以及抑制肿瘤细胞迁移和侵袭。
此外,CBD与其他药物具有良好的协同作用,一些临床报告显示CBD被用于治疗癌症。本文就CBD抑制肿瘤生长和转移的机制、CBD与其他抗肿瘤药物的协同作用以及CBD逆转肿瘤耐药的研究进展作一综述。总的目的是为CBD治疗的临床应用提供重要参考。
2、CBD的抗肿瘤机制
与正常细胞不同,肿瘤细胞具有无限复制、抗凋亡、持续血管生成、组织侵袭和转移的特性。CBD作为一种潜在的肿瘤治疗药物,通过调节控制肿瘤发生和发展的多个过程发挥其抗肿瘤作用。
.jpg)
图2.CBD的抗肿瘤活性(增殖、凋亡、自噬、血管生成、侵袭和转移)
2.1. CBD调节肿瘤细胞周期
细胞增殖受细胞周期调控,阻断肿瘤细胞的分裂周期是抗肿瘤的重要机制。真核细胞通过G1期快速合成RNA和蛋白质,这为S期的DNA合成提供了物质和能量。G2期组装细胞分裂所需的材料,并为M期或有丝分裂准备细胞。因此,除了克服S期和M期抑制肿瘤细胞增殖外,调控G1期和G2期对肿瘤治疗具有重要意义。一些研究已经证明CBD治疗可以使肿瘤细胞对G 0-G1期阻滞敏感。
在甲状腺癌和乳腺癌细胞中,CBD通过在G1/S期转换期间引起细胞周期停滞来发挥其抗增殖作用,但在非肿瘤细胞中没有类似的作用。在胰腺癌中,CBD通过与GPR55受体结合并剂量依赖性地阻断其活性来抑制细胞周期进程,导致MAPK/ERK信号通路的下调,G1/S转换的抑制,S期DNA合成的减少,以及胰腺癌细胞生长的抑制。
细胞周期受细胞周期蛋白和细胞周期蛋白依赖性激酶(CDK)的调节。细胞周期蛋白和CDK可以联合收割机形成异源二聚体,促进细胞周期的进程。cyclinE与CDK2形成的复合物可促进G1期向S期的转变。
Zhang等人研究表明,CBD通过显著下调p53蛋白的表达,上调p21蛋白和共济失调毛细血管扩张症突变基因的表达,抑制胃癌细胞周期蛋白E和CDK2的表达,导致细胞周期阻滞于G0-G1期,从而发挥抗增殖作用。类似的效果也有报道胶质母细胞瘤细胞。CBD通过特异性调节ERK和多种caspase-3、caspase-7和caspase-9的活性发挥其抗胶质母细胞瘤作用,导致U251和SF 126细胞停滞在G0-G1期。由CBD和THC组成的联合治疗可以显著增强这种抑制作用。
2.2.多种CBD相关通路可诱导肿瘤细胞凋亡
细胞凋亡是指细胞的自主和有序死亡。它由基因控制,与主动清除与身体不相容的多余或分化细胞,已完成其功能但不再使用/需要的细胞以及潜在危险的细胞的过程有关。因此,细胞凋亡被认为是生物体正常发育不可或缺的调节机制;然而,当细胞凋亡失控时,会导致各种疾病,包括肿瘤发生。细胞凋亡的缺陷或障碍可以破坏正常细胞的正常增殖、分化和死亡程序,并且这种破坏是肿瘤发生的潜在因素之一。
目前,临床上使用的放、化疗药物主要用于诱导肿瘤细胞凋亡,显示出疗效。最近的研究结果已经证实,CBD可以发挥其抗肿瘤作用,诱导肿瘤细胞凋亡,通过几个过程,包括线粒体稳态的破坏和内质网应激(ERS)的实施。
线粒体是细胞凋亡调控的活性中心,在细胞凋亡途径中起重要作用。在正常生理条件下,细胞和线粒体中的各种抗氧化系统可以调节线粒体活性氧(ROS)的产生,以维持细胞内ROS的稳态。线粒体ROS稳态的破坏是体内疾病发展的重要因素。
在乳腺癌MDA-MB-231细胞中,CBD诱导BH3相互作用结构域死亡激动剂(BID)的产生和易位,增加细胞色素C的释放,并最终通过降低线粒体膜电位促进细胞凋亡。此外,CBD处理可以增加ROS的产生。使用抗氧化剂α-生育酚(TOC)限制ROS水平可以降低CBD诱导的凋亡蛋白的表达,再次暗示ROS参与凋亡。
其他研究表明,CBD激活白血病Jurkat细胞中的半胱天冬酶级联反应,导致PARP裂解,NADH氧化酶表达上调,ROS产生增加,最终导致细胞凋亡。Massi等人[17报道CBD通过早期ROS的产生和谷胱甘肽(GSH)的消耗激活半胱天冬酶-8和半胱天冬酶-9来触发胶质瘤细胞的凋亡。
另一种凋亡触发因子是ERS,其定义为响应于缺氧、酸中毒和其他应激刺激而在内质网中积累未折叠或错误折叠的蛋白质。高强度和持续的应激反应可诱导细胞凋亡。在结肠癌细胞中,CBD通过磷酸化双链RNA依赖性蛋白激酶样ER激酶-C/EBP同源蛋白(PERK-CHOP)诱导ERS并增加死亡受体DR 5的表达,同时还增强肿瘤坏死因子相关凋亡诱导配体(TRAIL)诱导的肿瘤细胞凋亡。
此外,CBD剂量依赖性地诱导胃癌细胞系(AGS、MKN 45、SNU 638和NCI—N87)的凋亡。CBD作用的分子机制涉及通过将促凋亡因子Smac易位至细胞质以结合X连锁凋亡抑制蛋白(XIAP)来诱导ERS和线粒体功能障碍,从而增加胃癌细胞中XIAP的泛素化。
CBD还可以通过其他方式诱导肿瘤细胞凋亡。Sreevalsan等人表明CBD促进前列腺癌LNCaP和结肠癌SW 480细胞中的磷酸酶依赖性和/或CB受体依赖性凋亡。在肺癌中,CBD通过上调粘附分子ICAM-1和淋巴因子激活的杀伤细胞(LAK)介导的肿瘤细胞死亡诱导H460和A450细胞凋亡。
微小RNA(miRNA)是一种短的非编码RNA,也可能通过调节细胞凋亡参与肿瘤的发病机制。阿尔哈里斯等人发表了第一份报告,表明CBD可以通过miRNA控制肿瘤细胞的侵袭,迁移和凋亡。CBD可特异性下调miRNAhsa-let-7a,上调caspase-3和GAS-7基因的表达。这些变化,反过来,激活神经母细胞瘤(NBL)细胞凋亡。
2.3. CBD诱导肿瘤细胞自噬
除了其促凋亡作用外,CBD还表现出诱导肿瘤细胞自噬的能力。自噬被认为是II型程序性细胞死亡,包括由错误折叠的蛋白质或功能失调的细胞器的分解引发的细胞死亡。自噬在肿瘤发生、发展、代谢和转移的各个阶段起着关键作用,因此对许多恶性肿瘤具有双重影响。
在肿瘤发生的初始阶段,自噬通过消除有缺陷的蛋白质和细胞器而潜在地阻碍了癌的发生。不幸的是,在癌症进展的晚期阶段,特别是当肿瘤面临压力源(例如,限制血管生成、营养缺乏和缺氧),自噬承担促生存作用,反而促进肿瘤增殖、转移和侵袭。因此,细胞自噬已成为肿瘤治疗的焦点。因此,CBD通过激发肿瘤细胞中的自噬来发挥其抗肿瘤作用的确切机制已经引起了广泛的关注。
CBD诱导人结肠上皮细胞系中自噬标记物LC 3-II蛋白的聚集。在自噬过程中,LC 3蛋白被合成并被ATG 4水解以产生细胞质LC 3-I,然后在Atg 7和Atg 3的作用下与磷脂酰乙醇胺共价结合。LC 3-I随后脂酰化形成LC 3-II,其结合自噬体膜形成自噬体[29].这一过程已在几种结直肠癌(CRC)细胞系中得到证实。
此外,在神经胶质瘤细胞中发现CBD诱导的LC 3-II过表达。然而,在这些细胞中,CBD增强了早期自噬通量,而不是促进完整的自噬过程。CBD诱导的细胞死亡可以被早期自噬抑制剂(wortmannin和LY 294002)阻断,而晚期自噬抑制剂(CQ和Baf-A1)促进细胞死亡。
噬过程与细胞凋亡密切相关,一些研究证实CBD诱导的自噬反应有时与细胞凋亡共存。这些反应之一与Beclin-1有关,Beclin-1是一种哺乳动物自噬基因,也是调节自噬的关键靶点。Beclin-1可以与Bcl-2家族蛋白结合形成蛋白复合物,调节自噬水平。CBD可以抑制Beclin 1和Bcl-2之间的连接,从而增加自噬水平。
在乳腺癌MDA-MB-231细胞中,CBD处理诱导ERS,导致LC 3-II的积累并触发自噬细胞死亡。在这种情况下,凋亡产生的大量caspase-3切割Beclin-1并阻断自噬。同时,裂解产物被转移到线粒体,在那里它通过促进Cyt-c释放来诱导细胞凋亡。
有趣的是,细胞凋亡和自噬的优势似乎是由CBD的浓度决定的。CBD还上调急性髓性白血病(AML)-1转录因子,以PI 3 K/AKT依赖性方式结合瞬时受体电位香草素-2(TRPV 2)启动子,并激活TRPV 2以触发神经胶质瘤干细胞(GSC)的分化,从而激活自噬过程并抑制GSC生长。
此外,有研究在离体实验中证明,CBD和奥沙利铂联合治疗CRC细胞可降低一氧化氮合酶3(NOS 3)活性,导致线粒体功能障碍介导的ROS产生和ERS过多,最终诱导自噬,因此具有抗肿瘤作用。
2.4. CBD抑制肿瘤细胞血管生成
血管生成是内皮细胞增殖、粘附、迁移和血管环形成的动态过程,受血管生成介质和抑制剂的调节。不受控制的血管生成可导致多种疾病,包括一些免疫疾病(类风湿性关节炎)、肿瘤发生和肿瘤转移。许多研究支持CBD可以通过抑制肿瘤血管生成来发挥其抗肿瘤作用的可能性。
Solinas等人发现CBD在胶质瘤U87-MG细胞中显著干扰和降低参与血管生成过程的多种调节因子的蛋白表达,如血管内皮生长因子(VEGF)、基质金属蛋白酶-2/9(MMP-2/9)、基质金属蛋白酶抑制剂-1(TIMP-1)、尿激酶型纤维蛋白原激活剂(uPA)等,但没有鉴定出特异性信号通路。
其中,基质金属蛋白酶家族(MMPs)可通过基底膜的解体和细胞外基质的重塑参与血管生成。相比之下,TIMP-1是一种内源性金属蛋白酶抑制剂,抑制MMPs的活性。HIF-1α作为氧稳态的主要调节因子,在肿瘤血管生成和转移中起关键作用。
最近的一项研究表明,CBD可以通过抑制SRC活性来抑制乳腺癌的生长,从而上调VHL的表达,减少乳腺癌细胞中HIF-1α的合成,并抑制血管生成。肿瘤相关巨噬细胞分泌EGF并促进血管生成,在一项关于CBD在乳腺癌中的作用的研究中,报道了CBD抑制血管生成,从而发挥抗肿瘤作用。它通过调节肿瘤细胞产生的细胞因子来调节肿瘤微环境,从而减少总巨噬细胞和M2巨噬细胞向原发性和继发性肿瘤部位的募集。
虽然大麻素及其类似物在抑制血管生成中的作用已被广泛研究,但CBD的抗血管生成作用尚未得到充分研究。除了CBD的血管生成抑制作用的已被证实的靶点外,还出现了许多小分子和蛋白质,它们可能抑制血管生成,值得探索。
例如,近年来已经证明内皮TRPV 4是血管完整性和肿瘤血管生成的关键调节因子,这表明靶向TRPV 4可能代表血管正常化和癌症治疗的潜在新策略。鉴于CBD可以激活TRPV4,CBD可能通过靶向TRPV4发挥其抗血管生成作用。此外,GPR55也可以作为CBD作用的受体,GPR55通过降低TME中的神经生长因子(NGF)水平来影响内皮细胞增殖。因此,其相互关系值得深入研究,为抑制肿瘤血管生成提供新的途径。
2.5. CBD抑制肿瘤细胞侵袭和迁移
恶性肿瘤的显著特征包括其细胞的远距离侵袭和迁移能力。这些转移性细胞也是临床癌症患者死亡率的重要决定因素。研究结果证实了CBD抑制各种类型肿瘤细胞侵袭和迁移的能力。
上皮间质转化(EMT)由于其在良性肿瘤向侵袭性和转移性恶性肿瘤转化中的潜在作用而受到广泛关注。EMT是肿瘤侵袭和转移的关键过程。在EMT进展期间,许多基因经历改变的表达,包括上皮表型相关蛋白(例如,E-钙粘蛋白、角蛋白和紧密连接蛋白-1)和间充质表型相关蛋白(例如,N-钙粘蛋白、波形蛋白和纤连蛋白)、因此,靶向EMT相关信号有望成为阻止肿瘤进展的策略。
用CBD处理的CRC细胞显示由于Wnt/β-连环蛋白信号传导途径的破坏而抑制EMT过程。这种干预增加了E-钙粘蛋白的表达,降低了N-钙粘蛋白的表达,从而有效地阻断了Wnt通路,阻止了癌细胞的迁移。
类似地,在乳腺癌细胞中,CBD证明了通过促进E-钙粘蛋白和β-连环蛋白在细胞粘附连接处的重新定位来恢复由于细胞分散而损失的上皮组织的能力。CBD还通过阻断IL-1β诱导的IL-1β/IL-1 RI/β-catenin信号通路来阻止β-catenin的核转位,该信号通路调节迁移和进展,这是驱动EMT的关键因素之一。
因此,CBD可能通过逆转EMT来对抗肿瘤的侵袭和迁移。具有抑制侵袭潜力的CBD的另一个靶点是纤维蛋白原活化系统。在该系统中,纤溶酶原激活物抑制剂1是丝氨酸蛋白酶抑制剂的一员,可抑制纤维蛋白原激活剂,干扰恶性肿瘤细胞的侵袭。有研究证实,CBD通过大麻素受体1(CB1)/大麻素受体2(CB2)/TRPV 1依赖性通路抑制肺癌A549细胞表达,从而抑制细胞侵袭。
由肿瘤细胞合成和分泌的MMPs可靶向细胞外基质(ECM)中的多种蛋白并降解ECM,导致组织结构松弛,促进肿瘤细胞的侵袭和转移。CBD抑制EGF/EGFR信号通路的激活及其下游靶点AKT、ERK和NF-κB的活性,从而抑制肿瘤细胞增殖,同时通过下调MMP- 2和MMP-9的分泌,抑制乳腺癌细胞的侵袭和迁移,从而抑制乳腺癌细胞的侵袭和迁移。
据报道,转录调节因子Id-1在几种类型的癌症中表达失调,并且是肿瘤发生和转移的关键决定因素。在乳腺癌细胞中,麦卡利斯特等人通过分析三种不同类别的大麻素类化合物发现,对肿瘤细胞增殖、侵袭和迁移抑制作用最显著的化合物是CBD,进一步研究相关作用机制发现CBD可通过同时增加p—ERK和ROS来抑制乳腺癌细胞中转录调节因子Id—1的表达,从而降低细胞增殖和侵袭。
此外,在神经胶质瘤细胞中,CBD发挥类似的作用,在CBD作用后显著下调Id—1表达并减少胶质母细胞瘤细胞侵袭。此外,CBD在处理肺癌细胞系A549、H358和H460细胞后激活P38和MAPK,诱导TIMP-1的表达,从而降低肿瘤细胞侵袭,而体内实验证实CBD对A549小鼠模型的肺转移具有显著的抑制作用。
一项使用小鼠乳腺癌转移模型的早期研究也证实,CBD将乳腺癌转移到肺部的总转移减少到75%,抑制肺转移的生长,并且在其抗肿瘤侵袭能力方面显示出比其抑制原发性肿瘤生长的能力更大的效力。
2.6. CBD影响肿瘤细胞的能量代谢
肿瘤的一个显著特征是肿瘤细胞的代谢重编程,肿瘤细胞内的异常代谢可加速肿瘤的恶性进展。其主要方式包括糖酵解、氧化磷酸化、氨基酸代谢、脂肪酸代谢等,在正常情况下,有氧氧化是机体获得能量的主要途径。在缺氧期间,身体通过糖酵解产生能量。瓦尔堡指出,即使在有氧条件下,肿瘤细胞也更有可能通过糖酵解提供动力。
然而,糖酵解确实为肿瘤细胞的生命活动产生ATP,它也为蛋白质和脂质合成提供中间体。从而促进肿瘤细胞的生长和增殖。这表明CBD还可以通过调节肿瘤细胞的能量代谢来发挥其抗肿瘤作用。
有研究表明,CBD显著降低细胞基础呼吸速率和总ATP生成,从而抑制人胃癌AGS细胞的生长。在神经母细胞瘤(NBL)细胞中也观察到类似的效果。CBD通过抑制线粒体呼吸来延缓NBL细胞的生长,尽管糖酵解的速率没有显著改变。迄今为止,很少有报道涉及CBD调节肿瘤细胞生物能量代谢的具体机制。我们最近的研究表明,CBD可以通过破坏LAIR-1介导的线粒体生物能量代谢和PI 3 K/AKT/mTOR通路的干扰来抑制卵巢癌细胞的生长。
上官等人表明CBD可以通过调节ATF 4-IGFBP 1-AKT轴和降低有氧糖酵解和能量代谢的总体速率来抑制肝癌HepG 2和MHCC 97 H细胞的生长。最近,Sun等人使用单细胞RNA测序(scRNA-seq)和单细胞ATAC测序(scATAC-seq)方法来检查施用CBD后小鼠MC 38异种移植肿瘤的肿瘤微环境(TME)。
他们的研究结果表明,在巨噬细胞中,CBD抑制氧化磷酸化和脂肪酸氧化,同时通过抑制PI 3 K-Akt信号通路和相关下游靶基因促进糖酵解。此外,CBD显著减少了交替激活的M2巨噬细胞的数量,并相应地增加了M1巨噬细胞的数量,从而显著促进了抗肿瘤免疫,抑制了荷瘤小鼠的肿瘤生长。
肿瘤耐药性仍然是限制成功的肿瘤治疗的主要挑战之一。代谢重编程,特别是糖酵解途径的重编程,与恶性肿瘤的耐药性密切相关。最近在前列腺癌转基因小鼠模型中的一项研究证实,CBD通过重新编程代谢和致癌相关信号来抑制该模型中难治性前列腺癌(HRPC)的发展。
在机制上,CBD通过增加糖酵解能力和抑制氧化磷酸化来抑制恩杂鲁胺耐药HRPC细胞中的氧化磷酸化。CBD的这种作用源于其通过调节PI 3 K/Akt/mTOR途径抑制线粒体电压依赖性阴离子通道1(VDAC1),这是线粒体外膜中的一种关键蛋白,参与线粒体和细胞功能的控制。
线粒体功能和细胞凋亡的调节与己糖激酶II(HK-II)活性偶联,因为切断HK-II反应所需的ATP供应导致细胞凋亡和自噬。因此,当VDAC 1寡聚化抑制剂DIDS与CBD组合提供时,CBD对细胞存活和线粒体ATP产生的影响显著降低。显然,肿瘤细胞的耐药性可以响应于内源性代谢的改变而改变,这一可能性为旨在克服耐药性的新型治疗剂的开发提供了充满活力的新思路。
3、抗肿瘤药物的协同增敏与耐药性逆转
化疗是多种癌症的常用临床治疗手段,但患者在化疗过程中容易产生耐药性,导致治疗失败。许多中药产品的活性成分可以逆转肿瘤细胞的化疗耐药性。有证据表明CBD可以作为抗肿瘤药物增敏剂应用于恶性肿瘤的治疗,并且CBD可以有效逆转肿瘤耐药性。一些临床前研究,包括细胞和动物实验,已经研究了CBD与抗肿瘤药物的联合使用。下面是在不同类型的肿瘤中测试的CBD组合的一些情况。
CBD与化疗药物具有协同作用。DNA损伤药物仍常用于某些恶性肿瘤的治疗,但对这些药物的耐药性明显。一些研究表明,CBD可以通过TRPV 2通道增加钙离子摄取,从而增强细胞对化疗药物的摄取,并随后增加胶质瘤细胞对化疗药物的敏感性,包括DNA损伤药物(替莫唑胺,卡莫司汀或顺铂)。
此外,Massi等人在使用神经胶质瘤组织和细胞的离体实验中证明,CBD通过调节脂氧合酶(LOX)途径和内源性大麻素系统来抑制肿瘤生长,而用5—LOX特异性抑制剂MK—886预处理增强了CBD的抗有丝分裂能力,这表明CBD和5—LOX抑制剂可增强CBD的作用,TRAIL同时与相应受体作用,但也会导致抗药性、血浆半衰期短等问题。Kim J.L.等人发现CBD与TRAIL在体外具有协同抗肿瘤作用,这可以增加其敏感性;然而,在正常结肠细胞中未观察到这种协同作用。
最近的一项研究表明,CBD与光动力疗法(PDT)结合可增强细胞毒性物质的产生,刺激患者的免疫系统,并干扰与肿瘤发生、耐药性和转移调节相关的多种信号通路,从而防止结直肠癌干细胞的继发性扩散,增强PDT在结直肠癌中的治疗效果。 Mokoena等人也注意到CBD和PDT的联合治疗对MCF-7乳腺癌细胞具有强的体外杀伤作用,并且他们提出该机制可能与诱导凋亡有关。在肝细胞癌中,大麻二酚通过调节ERS下的p53磷酸化促进卡博替尼诱导的肿瘤细胞死亡。
一些研究已经证实,GSC对常规抗肿瘤药物卡莫司汀(也称为BCNU)的治疗具有显著抗性,因为BCNU治疗后GSC的细胞活力仅略有下降。然而,当与CBD联合使用时,由于CBD诱导了BCNU依赖的细胞凋亡,BCNU的细胞毒性增加,从而克服了GSC对BCNU治疗的高抗性。
ROS也参与胶质母细胞瘤的耐药性,CBD治疗携带GSC肿瘤的小鼠大大增加了它们的肿瘤ROS水平。这抑制了GSC肿瘤细胞的存活和自我更新,并显著增加了小鼠的存活率。CBD与抗氧化反应基因抑制剂的结合进一步增强了抑制肿瘤生长、侵袭和GSC自我更新的能力。
Jeong等人[34]建立了奥沙利铂耐药的DLD-1 R和Colo 205 R结直肠癌细胞系,并显示NOS 3磷酸化水平升高是奥沙利铂耐药的关键。他们还证实,CBD和奥沙利铂的组合可以通过线粒体功能障碍诱导ROS的过度产生,这进一步抑制了NOS 3磷酸化以克服奥沙利铂耐药性。另一项体内实验证实,在胰腺导管腺癌小鼠模型中,CBD和吉西他滨(GEM,治疗胰腺导管腺癌最常用的药物之一)的组合将存活时间延长至单独GEM的近三倍。
类似地,CBD和伊马替尼(一种治疗慢性粒细胞白血病(CML)的靶向药物)的组合逆转了伊马替尼耐药性。Ozmen等人通过病理组织学检查证实,CBD治疗逆转了通常与使用甲氨蝶呤(MTX)相关的肺中充血、水肿、炎性细胞浸润和上皮细胞损失的病理学。MTX是一种广泛用于治疗各种癌症的药物,但它的使用会对器官,特别是肺部造成不良影响。
细胞外囊泡(extracellular vesicles,EVs)包括外泌体(exosomes)和凋亡囊泡(apoptosis vesicles,EMV),它们在机体的生理和病理过程中起着重要作用。肿瘤中EMV的释放与癌细胞的化疗耐药性有关。
Kosgodage等人证明CBD显著减少了三种不同癌细胞系,即前列腺癌(PC3)、肝细胞癌(HEPG2)和乳腺癌(MDA—MB—231)中外来体和EMV的释放,并进一步证明CBD的调节作用是剂量依赖性和肿瘤细胞类型特异性的,并导致肿瘤细胞对化疗的敏感性增加。
近年来,载药颗粒技术也被应用于抗肿瘤药物组合的递送,以实现精确靶向,降低转移风险,降低肿瘤耐药性。一个研究小组评估了CBD与紫杉醇(PTX)联合治疗卵巢癌的协同活性,发现可以减少PTX的剂量,从而降低与药物相关的毒性和耐药性。此外,PLGA颗粒可以作为CBD的载体,并提高PTX的抗肿瘤活性,而不是阿霉素和顺铂。
事实上,CBD表现出拮抗作用。另一项研究表明,CBD整合到仿生一氧化碳纳米复合物(HMPOC@M)中增加了自噬通量,并通过激活III类磷脂酰肌醇3-激酶(PI 3 K-III)/BECN1(Beclin-1)复合物促进了癌细胞死亡。同时,体内实验表明,HMPOC@M+激光治疗通过下调VEGF和MMP 9蛋白而强烈减弱肝和肺转移并抑制肿瘤生长。
4、肿瘤防治的临床应用
虽然许多体外和临床前体内研究已经探索了CBD对不同类型癌症的抗肿瘤机制,但实际上将CBD作为癌症治疗的临床试验很少。Kenyon J. et al. 对从119名癌症患者中收集的数据进行了常规分析,并报告说,约92%的实体瘤患者在接受合成CBD药物治疗后临床症状良好。改善包括肿瘤缩小和循环细胞数量减少,并且没有发现明显的副作用。
巴里等人报道了一名患有浆液性卵巢癌的患者,他每晚用CBD油的舌下滴剂治疗两个月,并与含有扁桃酸的苦杏仁片组合。患者的随访CT结果显示双侧肿块缩小,盆腔淋巴结肿大。同样,Sule-Suso et al. 报道,根据CT扫描,用CBD油治疗一名患有肺腺癌的老年患者一个月,导致左下叶肿块几乎完全消失,纵隔淋巴结显著减少。这些不同类型癌症的临床病例提供了令人信服的证据,证明CBD的使用对肿瘤患者有显著的益处。CBD的临床实验研究仍需进一步完善。
5、总结与前景
CBD在不同类型癌症中的抗肿瘤作用已引起广泛关注,相关研究成果数量正在稳步增加。迄今为止发表的研究都指出CBD具有明显的抗肿瘤作用,其机制包括诱导细胞周期停滞和自噬,促进细胞凋亡,调节血管生成以及抑制肿瘤细胞迁移和侵袭。此外,CBD与其他药物具有良好的协同作用,一些临床报告显示CBD被用于治疗癌症。本综述中提出的结果表明,CBD在治疗癌症患者的临床应用中具有非常有前途的潜力。
CBD由于结构简单、水溶性差、生物利用度低、抗氧化性和稳定性受到显著抑制等原因,迫切需要进行结构优化,限制了其临床应用。已经证实,聚合物合成、结构修饰和亲水基团的引入可以增强CBD的抗氧化性能,并改善其溶解性和渗透性。
虽然相关研究不多,但这无疑为CBD的进一步体内实验研究和临床应用提供了参考,具有广阔的应用前景。CBD的抗肿瘤机制似乎非常复杂。需要更详细和深入的研究,为推进CBD的临床应用提供更强有力的理论基础。
不要盲目嘲笑欧美的大麻法规改革,别人也许只是更尊重科学而已。
文章转自《汉麻CBD》公众号