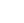
1)影响CBD的主要因素:
种植环境:室内还是室外?
照明和温度:自然光或人造卤素/钨卤灯泡或LED?
补气:自然空气(室外)或补充二氧化碳(室内)?
雄性与雌性植株:一起分析(田间),还仅仅是雌性(温室)?
授粉:是否允许雌性植株生产种子?
取样/收获时间:抽样时间对最终结果有很大影响!
实际样本:究竟哪个部分的植物被采样用于分析?
加工方法:是否需要萃取。如果是,如何萃取的?
萃取方法的效率是多少?
实验室能力:实验室的分析是否可靠?
分析方法:LC或GC,以及什么类型的检测方法?
2)工业规模的田间生产:
对于开放授粉的汉麻作物,可以用标准谷物联合收割机收割前三分之一的植物以回收麻籽和绿色植株部分。
植株部分将包括叶子,花,茎等。这必须在收割时或收割后与麻籽分开。
在任何情况下,必须在收割后的48个小时内开始干燥收割物,以避免一定程度的发霉。
3)较小规模的作物或温室条件的生产:
如果分析的样本中不包括茎和大叶,并且仅分析成熟的无籽雌性花的顶端,那么CBD的量将会很高。
4)抽样时间:
植物化学成分总是在整个汉麻植物的生命中发生变化。
对于工业规模生产的雄性和雌性植株,将收割时间与谷物收割联系起来是有意义的。这需要大量的计划和协调。必须根据自身的实际情况来解决这个问题。
对于成熟的无籽雌花的作物或温室规模生产,建议种植者观察叶子上的毛状体密度以确定最佳收割时间。同样,必须根据自己的情况来解决这个问题。
5)用于分析的样本:
显而易见的是,来自田间雌雄异株的大量植株样本将比室内无籽且精心修剪的雌花具有更少的CBD含量。这些是完全不同的样品,在完全不同的生长条件下生产。同样,了解样本的上下文非常重要,以便了解分析数据的真实价值。
6)分析方法:
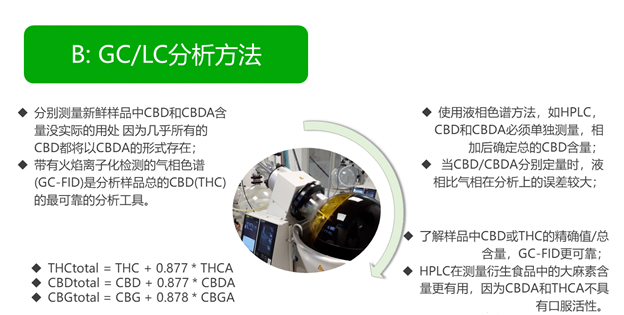
l 在新鲜的汉麻样品中分别测量CBD和CBDA没有实际的用处,因为几乎所有的CBD都将以CBDA的形式存在。由于这个原因,带有火焰离子化检测的气相色谱(GC-FID)是分析汉麻样品中总CBD(或THC)的最可靠的分析工具。GC-FID更可靠的一个原因是因为只对总CBD进行了一次分析。使用液相色谱方法,如HPLC,CBD和CBDA必须单独测量,然后加在一起以确定CBD的总量。当CBD和CBDA分别定量时,与分析仅使用GC-FID对总CBD计算一次相比,发生分析错误的可能性更大。
l 如果目标是了解汉麻样品中CBD或THC的精确值和总价值,那么GC-FID是最可靠的分析方法。然而,HPLC分析方法在测量汉麻衍生食品中的大麻素含量方面更有用,因为CBDA和THCA不具有口服活性,消费者必须知道在可食用的食品中的“免费”CBD和THC的含量是多少。
7)如果市场是欧洲的话,就得详细了解一下DAC分析方法,否则也比较难进入欧洲市场。

总之,影响CBD含量的因素很多,不过后天的因素占据比较大。同样的种子,在同一块田地里,不同的人种植出来的结果却有很大不同。因此,要想获得高含量的CBD,必须要精心呵护照料才行,毕竟这是个现代科技农业项目,不是单纯的农业项目。
来源:中欧汉麻枢纽
文章转自《新麻在线》